Valeur énergétique
Chez les volailles, l’énergie digestible n’est pas retenue pour caractériser la fraction de l’énergie brute ingérée utilisable par l’animal puisque les fèces et l’urine sont excrétés simultanément au niveau du cloaque. A l’inverse, l’énergie métabolisable (EM) est relativement simple à mesurer et de ce fait constitue le système énergétique le plus employé. Son calcul répond à l’équation suivante :
EM = (EBi – EBe) / Qa
où EBi et EBe sont respectivement les énergies brutes ingérées et excrétées, et Qa la quantité d’aliment ingérée. Chez les oiseaux, les pertes gazeuses sont négligées. La mesure in vivo de l’EM consiste donc en un bilan digestif dans lequel on détermine précisément les quantités ingérées et excrétées ainsi que les concentrations en énergie brute de l’aliment et des excréta préalablement déshydratés. Cette technique dite de collecte totale est privilégiée par rapport à celles utilisant un marqueur.
L’EM se décline en EM apparente ou vraie corrigées ou non pour le bilan azoté. Dans l’EM apparente (EMA), il n’est pas tenu compte des pertes d’origine endogène qui ne proviennent pas directement de l’aliment ingéré mais qui sont constituées de sécrétions digestives, de desquamations intestinales, de corps bactériens, de constituants azotés issus du catabolisme des protéines,… Cette EM sous-estime donc la valeur énergétique des aliments lorsque les niveaux d’ingestion sont faibles puisque, dans ces conditions, la part de l’endogène dans l’excrété total devient importante. Pour rendre l’EM indépendante du niveau d’ingestion, Guillaume et Summers (1970) ont proposé de soustraire l’endogène de l’excrété total.
L’EM vraie (EMV) répond à la relation suivante :
EMV = (EBi – (EBe – EE)) / Qa = EMA + EE / Qa,
où EE est l’énergie endogène excrétée par le coq pendant le bilan digestif.
Ce concept a été appliqué par Sibbald (1976) lors de la mise au point d’une technique rapide et miniaturisée de mesure de la valeur énergétique « vraie » des aliments chez le coq adulte.
L’EM apparente ou vraie ne permet pas de comparer des oiseaux dont les niveaux de production et en particulier les rétentions protéiques, sont différents. En effet, si toutes les protéines ingérées par l’oiseau étaient parfaitement utilisées pour les synthèses, aucun composé azoté ne serait excrété et le bilan azoté serait positif. A l’inverse, si toutes les protéines ingérées étaient catabolisées, le bilan serait nul. Des bilans azotés négatifs sont aussi possibles lorsque l’animal excrète plus d’azote qu’il n’en consomme (animaux à jeun ou rationnés). Compte tenu de leur productivité : gain de poids ou production d’œuf, le poulet en croissance ou la poule pondeuse peuvent, par ce biais, présenter des EM supérieures à celles observées sur coq adulte dont le bilan azoté est en moyenne à l’équilibre. Ainsi, la correction de l’EM pour la rétention azotée des oiseaux permet la comparaison entre animaux et améliore la précision des mesures puisque dans un même groupe d’individus le bilan azoté est variable.
Ce bilan peut être mesuré ou estimé. La mesure consiste à doser l’azote contenu dans l’aliment et dans les fientes et le bilan azoté (ΔN) se calcule ensuite de la façon suivante :
ΔN = Qa x Na – Qf x Nf
Q et N sont respectivement les quantités et concentrations en azote de l’aliment (a) et des fientes (f).
Son estimation est réalisée en mesurant le gain de poids (GP) des oiseaux pendant le bilan et en considérant qu’il renferme 20% de protéines soit 3,2% (20 / 6,25%) d’azote. Cette teneur en protéines corporelles, plumes incluses, varie selon l’âge de l’oiseau. Le bilan azoté est alors égal à :
ΔN = GP x 0,20 / 6,25
Pour le calcul de l’EM à bilan azoté nul, on considère que l’acide urique est le constituant majeur de l’azote urinaire excrété et que la quantité d’énergie correspondant à 1 g d’azote excrété sous forme d’acide urique est de 8,22 kcal (ou 8,73 selon certains auteurs). Ainsi l’EM à bilan azoté nul (EMAn) se calcule de la manière suivante :
EMAn = EMA – 8,22 ΔN / Qa
De la même façon, une EMVn peut être calculée après avoir estimé les pertes endogènes non azotées : EENA = EE – 8,22 DN. Ces pertes endogènes hors azote ne représentent que quelques kcal par coq et par jour.
EMVn = EMAn – 8,22 DN / Qa + EENA / Qa.
En définitive l’EMVn est la meilleure estimation de l’énergie métabolisable de l’aliment puisqu’elle est indépendante du niveau d’ingestion et ne prend pas en compte la fraction endogène ne provenant pas directement de l’aliment. Au plan théorique, seules les EMVn sont additives. Cependant lorsque les niveaux d’ingestion sont proches de la consommation spontanée des oiseaux, EMAn et EMVn sont similaires.
Figure 1. Relation entre EMAn, EMVn et le niveau d’ingestion
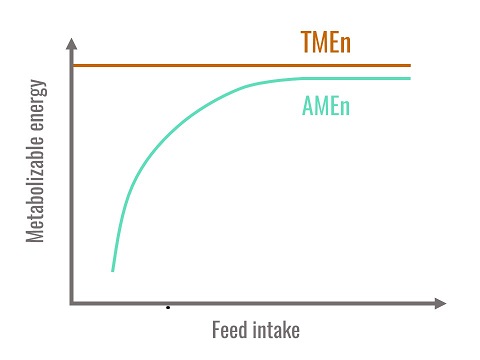
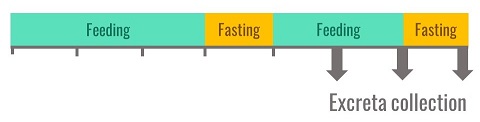
En pratique, la méthode la plus utilisée en Europe procède d’une alimentation ad libitum des volailles, qu’il s’agisse de poulets ou dindonneaux en croissance ou de coqs adultes. Un protocole de référence a été décrit au début des années 1990 (Bourdillon et al., 1990) et chaque laboratoire l’a ensuite simplifié. Il en est ainsi de celui pratiqué par INRAE. Les oiseaux sont tout d’abord accoutumés à l’aliment expérimental pendant trois jours, puis mis à jeun pendant une durée qui varie d’une nuit pour les jeunes poulets à 24 heures pour les coqs. Après installation du dispositif de collecte des excréta, les oiseaux sont nourris pendant deux jours puis de nouveau mis à jeun. Les excréta sont collectés en totalité pendant les trois derniers jours du bilan.
Figure 2. Protocole de mesure de l’énergie métabolisable utilisé par INRAE
Dans ces conditions, les niveaux d’ingestion sont élevés lorsque les aliments distribués ne présentent pas de problème d’appétence et seule l’EMAn est déterminée. Contrairement au gavage, cette méthode exclut toute mesure sur une matière première distribuée seule et qui serait peu ou pas consommée. On remplace donc une partie d’un aliment de référence connu par une proportion équivalente de la matière testée ; son EM est calculée par différence en faisant l’hypothèse de l’additivité entre les valeurs. Les taux d’incorporation des matières premières varient selon leur nature et les conditions pratiques d’emploi. Ainsi le maïs peut constituer 96 % de l’aliment alors que les corps gras ne représentent que quelques pour cents. Pour ce type d’ingrédients, plusieurs niveaux d’incorporation sont généralement pratiqués par les expérimentateurs afin d’estimer une éventuelle synergie et améliorer la précision de la mesure, qui est inversement proportionnelle au taux d’incorporation.
Les deux types de valeurs énergétiques présentées dans les Tables sont des EMAn. La première correspond au coq adulte (qui sert de référence dans de nombreux laboratoires) et la seconde est adaptée au poulet âgé de 3 semaines. Le poulet diffère du coq principalement par une digestibilité des lipides inférieure. Pour obtenir des EMA, il suffit de connaître ou de calculer la rétention azotée qui peut aller jusqu’à 40%, puis de la multiplier par la concentration en azote de l’aliment ou matière première et par 8,22 kcal. Le résultat ainsi obtenu est ajouté à l’EMAn.
Les valeurs d’EMAn présentées dans les Tables ont été établises à partir de données obtenues dans des conditions d’alimentation ad libitum provenant d’organismes de recherche ayant retenu comme technique de bilan digestif une méthode très proche de celle décrite ci-dessus. Ces valeurs ont ensuite été utilisée pour établir des équations permettant de calculer des valeurs d'EMAn tenant compte des compositions chimiques indiquées dans les Tables (Carré et Rozo, 1990 ; Fisher et McNab, 1987).
Valeur protéique
La valeur nutritionnelle d'une protéine dépend principalement de sa composition en acides aminés, mais la connaissance du profil des acides aminés est insuffisante pour juger de la qualité d'une matière première pour aliments pour animaux : les protéines peuvent être associées à d'autres composants tels que les glucides et elles peuvent également être modifiées par un traitement thermique, ce qui se traduit par des enzymes digestives moins efficaces. La digestibilité et l'utilisation métabolique des protéines alimentaires varient considérablement selon les matières premières et leurs traitements technologiques. Une estimation globale de la digestibilité des protéines peut être obtenue en utilisant la méthode publiée par Terpstra et de Hart (1974), qui consiste à séparer chimiquement l'azote urinaire de l'azote protéique non digéré, les deux étant éliminés au niveau du cloaque. L'acide urique est solubilisé, et les protéines non digérées sont ensuite précipitées à l'aide d'acétate de plomb. La teneur en protéines est mesurée par la méthode de Kjeldhal. Un facteur de correction (N total = 1,18 x N précipité) est appliqué pour tenir compte du fait que tout l'azote fécal n'est pas précipité et qu'une partie de l'azote urinaire est précipitée. L'estimation de la quantité de protéines alimentaires non digérées permet de calculer la digestibilité des protéines. Cette estimation approximative de la valeur des protéines a maintenant été remplacée par des mesures de la disponibilité et de la digestibilité des différents acides aminés.
Disponibilité des acides aminés
La disponibilité des acides aminés est définie comme la proportion d'un acide aminé qui est réellement utilisable par l'animal. Cette disponibilité n'est utilisée que pour les acides aminés essentiels et elle est estimée à l'aide de méthodes chimiques et biologiques. Seules les méthodes biologique ont un large éventail d'applications et sont capables de générer des données pour toutes les sources de protéines et leurs acides aminés. Les tests de croissance mesurent la capacité d'une protéine à remplacer un acide aminé essentiel, en particulier la lysine, dans l'alimentation d'un poulet en croissance. Une équation de régression entre le taux de croissance et la quantité de lysine ingérée est établie, en utilisant des régimes expérimentaux déficients en lysine complétés par des proportions croissantes de lysine-HCl (censée être disponible à 100 %). Dans le même temps, d'autres groupes de poulets reçoivent des régimes alimentaires formulés avec des quantités croissantes de la matière première testée, qui doit être la seule source de lysine. Les taux de croissance de ces animaux sont ensuite comparés à ceux des animaux recevant la lysine HCl. Cette méthode permet de mesurer la disponibilité d'un seul acide aminé à la fois et a été principalement développée pour la lysine. Elle ne prend pas en compte les interactions possibles avec les autres constituants de l'aliment testé, en particulier les facteurs antinutritionnels.
Digestibilité des acides aminés
Les méthodes de digestibilité in vivo qui permettent la caractérisation de tous les acides aminés alimentaires sont aujourd'hui les méthodes les plus courantes pour estimer la valeur protéique des matières premières pour l'alimentation des volailles. Elles consistent à déterminer la proportion de chaque acide aminé qui n'est pas éliminée dans les excréments. Ces méthodes correspondent à un bilan digestif où les quantités de chaque acide aminé ingéré et excrété sont mesurées, soit au niveau fécal, soit au niveau iléal. Comme l'activité microbienne est concentrée dans l'intestin postérieur et que les principaux sites d'absorption des acides aminés sont le jéjunum et l'iléon, l'analyse du contenu iléal plutôt que celle des fientes est une méthode plus précise pour évaluer la digestibilité des protéines et des acides aminés (Bryden et al., 2009). Dans les années 1990, l'INRA a effectué des mesures de la digestibilité réelle des acides aminés en utilisant des coqs adultes intacts (Zuprizal et al., 1990). Comme les oiseaux étaient gavés avec la quantité de nourriture nécessaire pour couvrir les besoins en protéines, la proportion de pertes endogènes dans les excréments était très faible. Les pertes endogènes ont été estimées en utilisant des animaux à jeun. La version précédente de ces Tables (Sauvant et al., 2004) présentait ces valeurs ainsi que celles obtenues à l'aide du même système et de méthodes similaires.
Depuis les années 2000, il est reconnu que la digestibilité iléale est une meilleure mesure de l'absorption des acides aminés par la volaille (Ravindran et al., 2017). Il existe deux méthodes principales, utilisant des poussins de 21 jours en début d'expérimentation :
- Le test standardisé sur jeunes poulets nourris ad libitum. C'est la méthode la plus répandue.
- Le test sur jeunes poulets nourris avec une quantité d'aliment précise. Les oiseaux sont à jeun de quelques heures à deux jours, puis reçoivent une certaine quantité d'aliment (souvent un seul) par le jabot.
Dans les deux cas, les digesta iléaux sont recueillis après abattage des poulets. Leur collecte via une canule iléale, comme chez le porc, est théoriquement plus précise, mais plus difficile à réaliser. En outre, elle doit être effectuée sur des animaux adultes et peut donc ne pas refléter la digestibilité chez les poulets de chair à croissance rapide. Des protocoles de mesure de la digestibilité iléale apparente et de digestibilité iléale standardisée ont été développés sont maintenant courants. Les concepts de digestibilités apparentes et standardisées sont identiques à ceux utilisés pour le porc. Ils sont décrits en détail pour cette espèce.
Au milieu des années 2010, le Centraal Veevoeder Bureau (CVB, Pays-Bas) a réalisé une collecte de données exhaustive de valeurs de digestibilité iléale en volailles. Quand il s'agissait de valeurs de digestibilité apparente, le CVB a obtenu des chercheurs les données expérimentales nécessaires au calcul des valeurs de digestibilité iléale standardisées. Les pertes basales de protéines endogènes utilisées pour la standardisation sont celles déterminées par Blok et Makkink, 2017. Des tables de valeurs de digestibilité iléale (apparentes et standardisées) des principales matières premières utilisées en volailles ont été publiées par le CVB en 2017 (Blok et Dekker, 2017). Avec l'autorisation des auteurs, ces données sont incluses dans les présentes Tables.
Disponibilité du phosphore
La disponibilité du phosphore végétal a longtemps été estimée à 30%, mais de nombreuses études ont montré une grande variabilité de ce critère qui dépend de l’activité phytasique endogène des sources végétales, de la proportion de phosphore phytique dans les matières premières et aussi des traitements technologiques subis. Cette disponibilité correspond au pourcentage de phosphore utilisé par l’animal par rapport à une source de phosphore disponible, généralement le phosphate monocalcique.
Un des critères biologiques retenu pour son estimation est la minéralisation osseuse puisque la quasi-totalité du phosphore corporel est contenue dans le squelette. Pour cela, on utilise de jeunes oiseaux nourris avec des aliments semi-synthétiques carencés en phosphore ou supplémentés avec des quantités croissantes de phosphore minéral (phosphate monocalcique) supposé disponible à 100 %. On établit ainsi une relation mathématique dose-réponse entre la quantité de phosphore ingéré et un critère de minéralisation osseuse, par exemple la teneur en cendres du tibia. En parallèle, d’autres animaux sont alimentés avec des aliments expérimentaux dont la seule source de phosphore est la matière première testée et l’on calcule également la relation entre phosphore ingéré et la minéralisation osseuse. Pour obtenir des relations linéaires entre les deux paramètres, tous les aliments sont formulés pour maintenir les oiseaux dans un état de sub-carence en phosphore. La disponibilité du phosphore de la matière première testée est égale au rapport des deux pentes des régressions ainsi calculées (fig.3). Cette méthode est la plus usuelle.
Figure 3. Mode de calcul de la disponibilité du phosphore
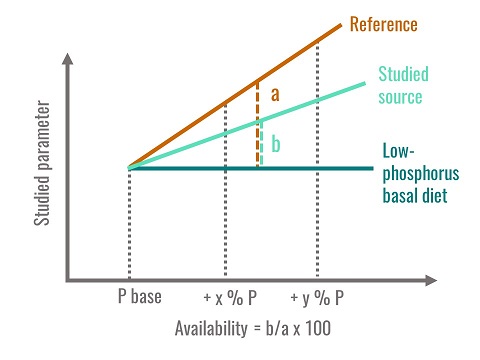
La disponibilité du phosphore est donc une valeur relative par rapport à une référence, elle ne correspond ni à une digestibilité, ni à une quantité de phosphore libéré dans les contenus intestinaux. Elle est déterminée pour le paramètre le plus sensible : la minéralisation osseuse et dans un état de sub-carence en phosphore afin d’être dans la zone de réponse linéaire. Les valeurs de disponibilité présentées dans les tables sont obtenues ainsi.
Il est également possible de mesurer la rétention de phosphore par bilan digestif. Cette évaluation de l’utilisation du phosphore aboutit à des valeurs généralement supérieures à celles obtenues par test de minéralisation osseuse.
Enfin, l’additivité des disponibilités du phosphore des matières premières n’est que partielle du fait d’une réponse curvilinaire de l’hydrolyse du phosphore phytique à un apport croissant de phytase. De plus, l’activité des phytases d’origine végétale ne correspond qu’à 60% de celle des phytases microbiennes. Une solution serait donc d’estimer la disponibilité du phosphore en considérant d’une part le phosphore non phytique et d’autre part en estimant la proportion de phytate hydrolysée à partir du phosphore phytique total et de l’activité phytasique présente dans le régime après traitement thermique.
References
- Blok M.C., Dekker R.A., 2017. Table ‘Standardized ileal digestibility of amino acids in feedstuffs for poultry’. CVB documentation report; No. nr. 61. Wageningen: Wageningen Livestock Research. https://doi.org/10.18174/426333
- Blok M.C., Makkink C.A., 2017. Amount and amino acid composition of basal endogenous protein losses at the terminal ileum of broilers. CVB Documentation report nr. 60. Wageningen: Wageningen Livestock Research.
- Bourdillon A., Carré B., Conan L., Duperray J., Huyghebaert G., Leclercq B., Lessire M., McNab J.M., Wiseman J., 1990. European reference method for the in vivo determination of metabolisable energy with adult cockerels: reproducibility, effect of food intake and comparison with individual laboratory methods. Brit. Poult. Sci., 31, 557-565.
- Bryden W.L., Li X., Ravindran G., Hew L.I., Ravindran V., 2009. Ileal Digestible Amino Acids in Feedstuffs for Poultry, RIRDC publication 09/071, University of Queensland, Kingston.
- Carré B., Rozo E., 1990. La prédiction de la valeur énergétique des matières premières destinées à l’aviculture. Prod. Anim., 3, 163-169.
- Fisher C., McNab J., 1987. Techniques for determining the metabolisable energy (ME) content of poultry feed. In: Recent advances in animal nutrition. 1987. Haresign W. and Cole D. J. A. Eds. Butterworths, London, 3-18.
- Guillaume J., Summers J. D., 1970. Maintenance energy requirement of the rooster and influence of plane of nutrition on M.E.. Can. J. Anim. Sci., 50, 363-369.
- Ravindran, V. ; Adeola, O. ; Rodehutscord, M. ; Kluth, H. ; Klis, J. D. van der ; Eerden, E. van ; Helmbrecht, A., 2017. Determination of ileal digestibility of amino acids in raw materials for broiler chickens – Results of collaborative studies and assay recommendations. Anim. Feed Sci. Technol., 225: 62-72 https://doi.org/10.1016/j.anifeedsci.2017.01.006
- Sibbald I. R., 1976. A bioassay for true metabolizable energy in feedingstuffs. Poult. Sci. ,55, 303-308.
- Terpstra K., De Hart N., 1974. The estimation of urinary nitrogen and fecal nitrogen in poultry excreta. Z. Tierphysiol., Tierernärh. Futtermittelkd., 32, 306-320.
- Zuprizal, Larbier M., Chagneau A. M., Lessire, M., 1990. Bioavailability of lysine in rapeseed and soyabean meals determined by digestibility trial in cockerels and chick growth assay. Anim. Feed Sci. Technol., 35, 237-246.
Auteur original : Michel Lessire (INRA). Texte révisé en June 2020 par Gilles Tran (AFZ)